2. 天津医科大学;
3. 天津市预防医学研究所
碘是机体必需的微量元素,可用来合成甲状腺激素,从而调节新陈代谢及生长发育。机体缺碘则会引起碘缺乏病,该病是严重危害人体健康的世界性公共卫生疾病,但随着全球食盐加碘项目的推行,其危害已逐渐得到控制,但碘对人体的影响却呈“U”型效应,近几年发现食盐加碘过量、水源水饮水碘含量过高、高碘饮食和医疗用碘等均可使人体摄入过量的碘,对人体造成健康损害[1]。近年来人群流行病学调查资料显示,高碘地区儿童智力明显低于适碘地区儿童,且存在剂量—反应关系[2]。动物碘化物染毒试验结果也证实,碘化物可通过胎盘屏障和血脑屏障进入脑组织,显著降低动物及其子代的学习记忆能力[3],提示高碘化物可引起以学习记忆损害为主的神经毒性,降低认知和反应速度。近年来的研究揭示,细胞自噬在神经发育和神经细胞成熟过程中具有重要作用[4]。适度的自噬可清除受损的细胞器和降解长寿命蛋白以及错误折叠蛋白以促进细胞生存[5]。但当应激过大时,细胞自噬可能被过度诱导活化,使其在生成和清除之间的平衡被破坏,则可能启动细胞自噬[6]。因此,本研究拟以人神经母细胞瘤细胞(SH-SY5Y)为模型,通过研究不同剂量碘对SH-SY5Y细胞存活率以及自噬相关指标的影响,探讨一定剂量碘对SH-SY5Y细胞的损伤作用及其机制。
1 材料与方法 1.1 主要仪器与试剂Model 680型酶标仪(Bio Rad 公司,美国),Ckx41 型倒置显微镜(Olympus公司,日本),KDC-1044型低速离心机(中科中佳公司,中国),SX-500型高压灭菌锅(TOMY公司,日本),膜针头式过滤器(Millipore公司,美国),PL203型电子分析天平(Mettler Toledo公司,瑞士)。
DMEM高糖培养基(Gibco公司,美国),优级纯胎牛血清(Gibco公司,美国),胰蛋白酶(Gibco公司,美国),青霉素和链霉素双抗溶液(100×;碧云天公司,中国),单丹黄酰尸胺(MDC,Sigma公司,美国),CCK-8试剂(同仁化学,日本),BCA蛋白质定量试剂盒(博士德生物技术公司,中国),蛋白质预染Marker(Fermentas公司,立陶宛),ECL发光试剂盒(Advansta公司,美国),碘化钾(KI分析纯,上海国药集团化学试剂有限公司,中国),其他试剂都为分析纯。
1.2 细胞培养将SH-SY5Y细胞株(南京大学高静教授馈赠)用含10%优级胎牛血清的DMEM高糖培养基培养于37℃、5% CO2的细胞培养箱中。
1.3 CCK-8实验检测细胞存活率将细胞种植于96孔板(4 000个/孔),继续培养至对数生长期,依据本课题组CCK-8预实验结果,分别加入不同浓度(0(对照),10,20和30 mmol/L)的KI溶液进行细胞染毒,每个剂量染毒组设6个复孔。KI染毒24 h后,向各孔中直接加入10 μL CCK-8试剂 ,37℃培养箱孵育2 h,用酶标仪在波长为450 nm 处测量各孔光密度(OD)值,并按照公式(1)计算细胞存活率。
细胞存活率=(OD染毒-OD空白)/(OD对照-OD空白)×100% (1)
1.4 自噬囊泡 1.4.1 细胞染毒将传代的SH-SY5Y细胞悬液以8×104/mL接种于6孔细胞培养板中,并于5% CO2、37℃培养箱中继续培养。48 h后吸去旧培养液并用PBS润洗2遍,再用浓度分别为0,10,20,30 mmol/L KI溶液染毒处理SH-SY5Y细胞24 h,每个剂量染毒组设3个复孔。
1.4.2 孵育染毒24 h后,将6孔细胞培养板中每个孔的细胞收获到对应离心管中,2 500 rpm离心5 min后弃去上清液,加入500 μL PBS重悬细胞,2 500 rpm离心5 min后弃去上清液并小心擦干管壁,再向各离心管中加入400 μL MDC应用液,37℃孵育15 min,室温避光染色5~10 min。染色完成后,2 500 rpm离心5 min 后弃去上清染液并小心擦干管壁,用500 μL PBS漂洗2次,再以800 μL PBS重悬。
1.4.3 检测使用335 nm激发波长,518 nm发射波长,在多功能酶标仪上检测每孔荧光强度。
1.5 自噬相关蛋白的检测染毒24 h后,收获细胞,提取细胞总蛋白,并按照BCA试剂盒说明书操作进行蛋白定量,将各组蛋白浓度调整一致后进行蛋白变性和分装。
经上样(8 μL),电泳(60 V,30 min,溴酚蓝进入积层胶后将电压调整至110 V,继续电泳30 min),转膜(330 mA,35 min),5%脱脂奶封闭,孵育一抗(Beclin1一抗比例1 ∶4 000,GAPDH一抗比例1 ∶8 000),洗膜(TBST摇床洗膜3次,8 min/次),孵育二抗(羊抗鼠比例1 ∶4 000,羊抗兔比例1 ∶4 000),洗膜(TBST摇床洗膜3次,8 min/次)后上机进行显影分析。
1.6 数据处理及统计分析实验数据以x±s形式表示,应用 SPSS 16.0软件进行统计学分析,多组数据间比较时,进行方差齐性检验和单因素方差分析 (One Way ANOVA)。若需进一步进行组间两两比较,方差齐时采用SNK检验(Student-Newman-Keuls法);方差不齐时采用Games-Howell检验。P<0.05为差异有统计学意义。
2 结果 2.1 不同浓度KI对SH-SY5Y 细胞存活率的影响CCK-8试验(n=6,x±s)结果显示,不同剂量 KI染毒组(0,10,20和30 mmol/L)SH-SY5Y细胞存活率分别为(100.00±4.09)%,(98.94±11.07)%,(87.22±9.58)%和(67.95±1.88)%,与对照组相比,20和30 mmol/L染毒组细胞存活率显著降低,差异有统计学意义(P<0.05);10 mmol/L染毒组差异无统计学意义(P>0.05)。
2.2 不同浓度KI对SH-SY5Y细胞自噬囊泡生成的影响20和30 mmol/L KI染毒组与0 mmol/L对照组相比较自噬囊泡荧光强度明显上升,差异有统计学意义(表 1;P<0.05);而10 mmol/L KI染毒组与对照组相比差异无统计学意义(P>0.05)。
| 碘化钾浓度/(mmol/L) | MDC荧光强度/FI |
| 0 | 345.00±3.00 |
| 10 | 341.00±1.00 |
| 20 | 415.00±15.88ab |
| 30 | 481.00±23.89abc |
| 注: a与0 mmol/L碘化钾相比较,P<0.05;b与10 mmol/L 碘化钾相比较,P<0.05;c与20 mmol/L碘化钾相比较,P<0.05 | |
可以看出,与其他各组相比,30 mmol/L KI染毒组自噬相关蛋白Beclin1表达明显上升,且差异有统计学意义(图 1;P<0.05)。
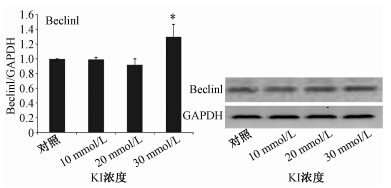
|
| 注:*与对照组相比,P<0.05 图1 不同剂量KI对自噬相关蛋白Beclin1表达的影响 |
许多物质在脑组织蓄积都可能引起神经毒性,铅可通过影响与学习和认知有关的大脑区胆碱能系统,进而影响神经系统[7];过量的氟化物可影响细胞膜和线粒体,破坏脑细胞内外正负离子正常的浓度差,导致膜内外钠、钾、镁离子浓度失衡,影响神经元代谢,破坏神经系统功能[8, 9],细胞凋亡也是高氟化物引起神经损伤的重要途径[1]。碘在人体内蓄积同样会造成神经毒性,其引起神经毒性的方式或途径也有很多,如高碘化物可诱导神经细胞凋亡[10];碘化物可通过促进海马神经细胞原癌基因c-fos、c-jun的表达进而影响神经功能发育[11];高浓度碘化物可造成动物海马组织乙酰胆碱酯酶(AChE)的增加,引起乙酰胆碱的降解增加,减慢神经细胞间的信息传递,降低动物学习记忆能力[12]。本研究发现,一定剂量的碘化物可使SH-SY5Y细胞存活率明显下降,细胞自噬水平也随着碘化物浓度的升高出现上升趋势。
自噬是细胞的代谢方式之一,作为一种细胞防御机制,他可以通过如清除细胞内大分子物质、代谢产物等方式保护受损细胞;然而,过度的自噬则有可能引发细胞死亡。MDC可特异性结合于膜脂,并在自噬囊泡处优先聚集[13],细胞内自噬囊泡的生成情况可通过其荧光强度来反映。Beclin1是首个被鉴定的介导哺乳动物自噬的基因,在自噬体的形成过程发挥着重要的作用。研究表明,很多调控自噬的蛋白,可以通过Beclin1不同的结构域或者氨基酸与Beclin1发生直接或者间接的结合,形成可调控自噬水平的蛋白复合体[14, 15, 16]。
研究表明,包括神经退行性疾病在内的许多人类重大疾病都与自噬有着密切的联系[17, 18, 19]。在神经系统中,自噬具有重要的生理功能:可缓解如营养和氧含量不足等引起的代谢应激;清除受损的细胞器,降解错误折叠蛋白;决定细胞的存活等[17]。自噬的作用就如同一柄双刃剑:一方面,他可以通过降解受损细胞器和大分子物质,从而为蛋白质和氨基酸的合成提供能量,降解在神经元中异常聚集的蛋白,保护神经元;另一方面,过渡活化的自噬可能导致自噬 应激,通过引起线粒体功能障碍等损伤细胞器,损伤神经细胞,进而损伤中枢神经系统。近年来研究发现,当自噬功能过强时也会对机体造成损伤,如在亨延顿氏舞蹈病中发现大量亨廷顿蛋白蓄积以及受损线粒体,为了清除异常蓄积的蛋白质和受损线粒体,细胞自噬被过度诱导活化,其生成和清除之间的平衡被打破,自噬体在细胞内蓄积,细胞最终走向自噬性死亡即Ⅱ型程序性死亡[20]。
综上所述,过量的碘化物可损伤神经细胞,造成细胞存活率明显下降,同时在高碘化物条件下,细胞的自噬水平明显上升,提示高碘化物诱导的细胞自噬可能参与其神经毒性作用。但高碘化物是通过何种通路诱导细胞发生自噬以及自噬是如何参与高碘化物的神经毒性作用的还有待进一步的探索。
| [1] | 许文宗. 汀溪水库群水源地保护措施初探[J]. 厦门科技,2008,15(3):5-7. |
| Click to display the text | |
| [2] | 孙昌盛,陈华,薛常镐,等. 同安水环境藻类及藻类毒素分布调查[J]. 中国公共卫生,2000,16(2):147-148. |
| Click to display the text | |
| [3] | Figueiredo DR, Azeiteiro UM, Esteves SM, et al. Microcystin-producing bloom-a serious global public health issue[J].Ecotox Environ Safe, 2004, 59(2): 151-163. |
| Click to display the text | |
| [4] | 中华人民共和国国家质量监督检验检疫总局. GB/T 20466-2006 水中微囊藻毒素的测定[S]. 北京:中国标准出版社,2006. |
| Click to display the text | |
| [5] | 国家环境保护总局. GB 3838-2002 地表水环境质量标准[S]. 北京:中国标准出版社,2001. |
| Click to display the text | |
| [6] | 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法(第四版)[M]. 北京:中国环境科学出版社,2002. |
| Click to display the text | |
| [7] | 金相灿,刘鸿亮,屠清瑛,等. 中国湖泊富营养化[M]. 北京: 中国环境科学出版社, 1990,31-50. |
| Click to display the text | |
| [8] | 毛敬英. 典型富营养化湖泊微囊藻毒素分布特征及主要影响因子差异性分析[D]. 西南交通大学,2012. |
| Click to display the text | |
| [9] | 李慧敏,杜桂森,姜树君,等. 官厅水库的微囊藻毒素及其与水环境的相关性[J]. 生态学报,2010,30(5):1322-1327. |
| Click to display the text | |
| [10] | 张琳,董泽琴,杨再荣,等. 贵州省红枫湖饮用水源地微囊藻毒素含量与水体中氮、磷含量等的相关性[J]. 环保科技,2009,15(3):1-11. |
| Click to display the text | |
| [11] | 杨希存, 王素凤,鄂学礼,等. 洋河水库微囊藻毒素含量与水污染指标的相关性研究[J]. 环境与健康杂志,2009,26(2):137-138. |
| Click to display the text | |
| [12] | 蔡金傍,李文奇,逢勇,等. 水库微囊藻毒素-LR 含量与环境因子的相关性研究[J]. 重庆建筑大学学报,2007,29(5):130-134. |
| Click to display the text | |
| [13] | 潘晓洁,常锋毅,沈银武,等. 滇池水体中微囊藻毒素含量变化与环境因子的相关性研究[J]. 湖泊科学,2006,18(6):572-578. |
| Click to display the text | |
| [14] | 朱美洁. 福州山仔水库富营养化和微囊藻毒素污染水平初步调查分析[J]. 福建分析测试,2013,22(2):58-62. |
| Click to display the text | |
| [15] | 芮翠杰. 平原水库富营养化调查分析及微囊藻毒素污染现状研究[D]. 青岛理工大学,2011. |
| Click to display the text |



